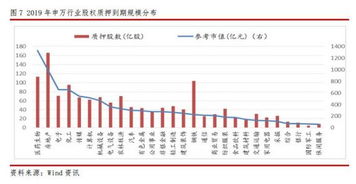
本文目录一览:
代码 | 名称 | *公告日期 |
603308 | 应流股份 | 06-07 |
601231 | 环旭电子 | 06-07 |
002975 | 博杰股份 | 06-07 |
301081 | 严牌股份 | 06-07 |
603035 | 常熟汽饰 | 06-07 |
002606 | 大连电瓷 | 06-07 |
002351 | 漫步者 | 06-07 |
002527 | 新时达 | 06-07 |
600814 | 杭州解百 | 06-07 |
600350 | 山东高速 | 06-07 |
603095 | 越剑智能 | 06-07 |
301079 | 邵阳液压 | 06-07 |
300114 | 中航电测 | 06-07 |
688655 | 迅捷兴 | 06-07 |
600184 | 光电股份 | 06-07 |
600295 | 鄂尔多斯 | 06-07 |
300407 | 凯发电气 | 06-07 |
000060 | 中金岭南 | 6月7日 |
000963 | 华东医药 | 6月7日 |
600965 | 福成股份 | 6月7日 |
600531 | 豫光金铅 | 6月7日 |
000555 | 神州信息 | 6月7日 |
601886 | 江河集团 | 6月7日 |
300849 | 锦盛新材 | 6月7日 |
601117 | 中国化学 | 6月7日 |
600929 | 雪天盐业 | 6月7日 |
603203 | 快克股份 | 6月7日 |
688139 | 海尔生物 | 6月7日 |
601860 | 紫金银行 | 6月7日 |
000570 | 苏常柴A | 6月7日 |
600057 | 厦门象屿 | 6月7日 |
301162 | 国能日新 | 6月7日 |
300035 | 中科电气 | 6月7日 |
688683 | 莱尔科技 | 6月7日 |
002230 | 科大讯飞 | 6月7日 |
300500 | 启迪设计 | 6月7日 |
301092 | 争光股份 | 6月7日 |
603909 | 建发合诚 | 6月7日 |
603351 | 威尔药业 | 6月7日 |
688210 | 统联精密 | 6月7日 |
002061 | 浙江交科 | 6月7日 |
600998 | 九州通 | 6月7日 |
300864 | 南大环境 | 6月7日 |
301086 | 鸿富瀚 | 6月7日 |
300141 | 和顺电气 | 6月7日 |
601579 | 会稽山 | 6月7日 |
688577 | 浙海德曼 | 6月7日 |
603050 | 科林电气 | 6月7日 |
002900 | 哈三联 | 6月7日 |
603530 | 神马电力 | 6月7日 |
603639 | 海利尔 | 6月7日 |
603233 | 大参林 | 6月7日 |
002645 | 华宏科技 | 6月7日 |
002836 | 新宏泽 | 6月7日 |
603577 | 汇金通 | 6月7日 |
688170 | 德龙激光 | 6月7日 |
688282 | 理工导航 | 6月7日 |
301021 | 英诺激光 | 6月7日 |
605005 | 合兴股份 | 6月7日 |
002970 | 锐明技术 | 6月7日 |
688226 | 威腾电气 | 6月7日 |
688622 | 禾信仪器 | 6月7日 |
近期,中证指数官网发布了多个指数样本的半年定期调整方案,其中中证100指数的样本调整数量达到45只,是中证100指数自2006年发布以来样本调整比例*的一次,成为了市场关注的焦点。
近半数调整更具投资价值
本次中证100指数调整幅度如此大,主要原因在于编制方案的修订。修订公告显示,此次中证100指数修订不仅涵盖了样本空间的流动性筛选条件、增加单个样本权重不超过10%的限制等,还纳入了ESG投资理念。
那么修订后的中证100指数有何亮点?中银中证100ETF的基金经理赵建忠对此做了解读。
首先,新的编制方案颇受关注的一点就是优化纳入了ESG投资理念,不仅符合当前可持续投资导向,同时契合海外投资者的投资习惯。近年来ESG产品规模增长迅速,国内ESG概念的被动指数型产品规模增长更为突出。此次修订后,中证100指数成为A股宽基指数中*进行了ESG负面剔除的指数。
其次,修订后的新中证100指数的行业分布更加均衡,行业结构上电新、电子、医疗保健等成长性较强的赛道权重整体有了大幅提升,打破了大盘指数注重于金融地产的传统印象,重新定义了龙头标准。新编中证100指数不再容易受到单一行业波动带来的较大影响,成为真正的宽基指数,未来很可能能够更好地代表我国经济发展全貌。
此外,在新的行业结构下,中证100指数的成长性明显提升。调整后,指数纳入更多成长性股票。
数据中证指数有限公司,截止至2022年6月17日
如何布局指数相关产品?
整体来看,优化后的指数纳入了更多行业代表性的“核心资产”,那么对于投资者来说,有哪些适合的工具可以布局中证100指数呢?
从产品来看,目前市场上挂钩中证100指数的产品包括了指数增强型基金、普通指数基金、ETF、LOF。
不同的产品有其自身特点,适合不同的投资者:
•指数基金:指按照某种指数构成的标准购买该指数包含的证券市场中的全部或者一部分证券的基金,其目的在于达到与该指数同样的收益水平。指数基金具有客观稳定、收费较低等特点。
•ETF:即上市交易型开放式指数基金,是一种在交易所上市交易的、基金份额可变的一种开放式基金,是指数基金的重要品种。这类基金实行一级市场与二级市场并存的交易制度。在一级市场,ETF在申购和赎回有数量上的*要求,有门槛限制。
•ETF联接基金:是投资于ETF基金的基金,让没有股票账户、资金量不够大的投资者也能参与其中。
•指数增强型基金:在跟踪指数的基础上,运用增强策略意图获取超额收益。指数增强型基金是被动投资与主动投资的结合。
•LOF:上市开放式基金,既可以在场外进行基金份额申购或赎回,又可以在场内进行基金份额申购赎回和交易。
从基金公司来看,中银基金是市场上对中证100指数产品布局最早、产品形式最全的公司之一。2009年9月份中银基金发行中银中证100指数增强型基金,是市场上首批以中证100指数为跟踪标的的指数产品,随后在2020年发行了中银中证100ETF及相关联接产品。
除了较早布局之外,中银基金指数及量化投研团队也是阵容强大。作为中银中证100ETF及联接基金的基金经理,赵建忠已有16年证券从业年限,在指数及ETF产品方面经验丰富,管理有中银上海金ETF及联接基金、中银中证800ETF及联接基金等多只产品。
风险提示:投资有风险,在市场波动等因素的影响下,基金投资有可能出现亏损,在少数极端情况下可能损失全部本金。基金管理人不保证基金一定盈利,也不保证*收益,基金的过往业绩并不预示其未来表现,基金管理人管理的其他基金的业绩并不构成基金业绩表现的保证。投资者投资基金前,应详细阅读基金的招募说明书、基金合同、产品资料概要等法律文件,了解具体产品情况,并根据自身情况判断基金是否与其风险承受能力相匹配。文中观点不构成中银基金的投资建议或任何其他忠告,并可能随情况的变化而发生改变。基金管理人与股东之间实行业务隔离制度,股东并不直接参与基金财产的投资运作。
(CIS)
股票代码:600521股票简称:华海药业公告编号:临 2022-021号
债券代码:110076债券简称:华海转债
本公司及董事会全体成员保证公告内容不存在虚假记载、误导性陈述或者重大遗漏,并对其内容的真实、准确和完整承担个别及连带责任。
重要内容及风险提示:
● 本次许可内容:
Medicines Patent Pool Foundation(药物专利池基金会,以下简称“MPP”)授予浙江华海药业股份有限公司(以下简称“公司”或“华海药业”)使用相关专利和专有技术生产口服新冠病毒治疗药物“奈玛特韦(Nirmatrelvir)”的仿制药和许可产品“奈玛特韦/利托那韦组合”,并在区域内(即95个中低收入国家,不包括中国)商业化许可产品及相关权利的非*许可。
上述生产包括对(1)奈玛特韦原料(药)及成品药(制剂)的生产,以及(2)奈玛特韦/利托那韦组合的生产。
特别风险提示:
1、本次许可为非*许可,获许可区域为95个中低收入国家,不包括中国。
2、本次许可下相关产品在商业化生产前,尚需完成相关技术交接且生产设施需经 SRA(严格监管机构,包括国际人类用药技术要求协调理事会(ICH) 成员、或 ICH 观察员及与 ICH 成员相关监管机构等)批准或经世界卫生组织预审合格。
3、本次许可下相关产品的生产、在区域内销售等,须待相关主管机构的批准后(包括但不限于上市批准)方可实施。公司基于本次许可所生产的许可产品在相关区域内能否获得当地药品监管机构批准以及在该区域内上市销售的时间尚存在不确定性。
4、本次许可下相关产品在区域内上市后的销售情况受新冠肺炎疫情发展、生产及供应链能力、市场竞争环境、销售渠道等诸多因素影响,存在不确定性。截至本公告日,公司就许可产品尚无在手订单、尚未开展相关生产。
根据协议,公司将按照产品的实际成本(可通过第三方审计核实)加上合理加价(待定)进行供应。鉴于本次合作旨在帮助95个中低收入国家可负担地获取许可产品,相关定价预计将低于原研产品或在其他中高收入国家的售价,截至目前,该许可产品的具体成本和定价等暂无法确定,对公司未来业绩影响尚无法预计。
5、根据公开信息,截至本公告日,于全球范围内,辉瑞的奈玛特韦/利托纳韦组合包装药物已获得(其中主要包括)美国食品药品监督管理局(美国FDA)的紧急使用授权(EUA)、欧洲药品管理局(EMA)的有条件批准、日本厚生劳动省的紧急特例批准、中国国家药品监督管理局的应急附条件批准等。截至本公告日,该许可产品的临床数据仍有限,使用该药物可能会发生未曾报告过的严重不良事件或非预期的不良事件。
一、媒体报道情况
近日,MPP发布公告及相关媒体报告称,MPP 向包括华海药业在内的35家药企授权生产新冠病毒治疗药物奈玛特韦/利托那韦的仿制药。
二、相关情况的核实
公司与MPP签订的《分许可协议》的主要内容
1、许可内容
基于Pfizer-MPP协议,MPP授予华海药业在区域内(即印度尼西亚、越南、埃塞俄比亚等95个中低收入国家)使用相关专利和专有技术,对“奈玛特韦(Nirmatrelvir)”的仿制药和许可产品(“奈玛特韦/利托那韦组合”)开展生产,并对许可产品进行商业化(包括注册、零售、分销等)的非*许可(以下简称“本次许可”)。
许可产品是一个组合包装的口服小分子新冠治疗药物,其包括两个抗病毒药物,即奈玛特韦(Nirmatrelvir)和利托那韦(Ritonavir)。
本次许可下相关产品的生产将在经SRA批准或通过WHO PQ认证的生产设施上进行生产。
2、 产品价格
实际成本(可通过第三方审计核实)加上合理加价(经协商)。
3、 专利许可使用费
根据购买方性质的不同,华海药业应按照年度净销售额(定义依据协议)的5%或10%)向辉瑞支付专利许可使用费。但基于Pfizer-MPP协议,前述专利许可使用费将自WHO宣布COVID-19不再被列为“国际关注的突发公共卫生事件”的次月起开始收取。但在低收入国家的销售,将豁免向辉瑞支付专利许可使用费。
4、 其他
MPP有权依据《分许可协议》终止本次分许可。
5、 适用法律与争议解决
美国纽约法院具有专属管辖权。
双方如发生争议无法协商解决的,则可通过仲裁方式解决。仲裁地应为美国纽约。美国纽约法院具有专属管辖权。
三、许可产品的基本信息
许可产品是口服小分子新冠治疗药物“奈玛特韦/利托那韦组合”,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者。
根据公开信息,辉瑞的奈玛特韦/利托纳韦组合包装药物已获得(其中主要包括)美国食品药品监督管理局(美国FDA)的紧急使用授权(EUA)、欧洲药品管理局(EMA)的有条件批准、日本厚生劳动省的紧急特例批准以及中国国家药品监督管理局的应急附条件批准。
根据MPP官网(https://medicinespatentpoolorg/)公布的信息,包括华海药业在内,MPP目前已向全球35家药企授予非*的生产、商业化以及相关权利的许可,以向全球95个中低收入国家供应许可产品。
四、交易对方的基本情况
MPP,是一家由联合国支持的非营利性公共卫生组织,其主要办公地位于瑞士日内瓦。MPP通过自愿许可和专利池的创新方法,致力于增加中低收入国家/ 地区获得药品的机会。
五、合同履行对公司的影响
1、本次合同签订为公司正常经营行为,不会对公司业务的独立性等构成重大影响,公司主营业务不存在因履行该合同对合作方形成依赖风险。
2、截至本公告日,公司就合作药品尚无在手订单、亦未开展相关生产,本合同的履行对公司当期业绩没有重大影响,对未来的业绩影响尚无法预计。
六、风险提示
2、本次许可项下许可产品在商业化生产前,尚需完成相关技术交接且生产设施需经 SRA(严格监管机构,包括国际人类用药技术要求协调理事会(ICH) 成员、或 ICH 观察员及与 ICH 成员相关监管机构等)批准或经世界卫生组织预审合格。
3、本次许可下相关产品的生产、在区域内的销售等,须待相关主管机构的批准后(包括但不限于上市批准)方可实施。公司基于本次许可所生产的许可产品在相关区域内能否获得当地药品监管机构批准以及在该区域内上市销售的时间尚存在不确定性。
4、本次许可项下许可产品在区域内上市后的销售情况受新冠肺炎疫情发展、生产及供应链能力、市场竞争环境、销售渠道及拓展等诸多因素影响,存在不确定性。 截至本公告日,公司就许可产品尚无在手订单、尚未开展相关生产。
根据协议,公司将按照产品的实际成本加上合理加价(待定)进行供应。鉴于本次合作旨在帮助95个国家可负担地获取许可产品,相关定价预计将低于原研产品或在其他中高收入国家的售价,截至目前,该许可产品的具体成本和定价等暂无法确定,对公司未来业绩影响尚无法预计。
5、根据公开信息,截至本公告日,于全球范围内,辉瑞的奈玛特韦/利托纳韦组合包装药物已获得(其中主要包括)美国食品药品监督管理局(美国FDA)的紧急使用授权(EUA)、欧洲药品管理局(EMA)的有条件批准、日本厚生劳动省的紧急特例批准、中国国家药品监督管理局的应急附条件批准等。
《中国证券报》、《上海证券报》、《证券时报》和《证券日报》为公司指定信息披露报刊,公司发布的信息以上述指定报刊以及上海证券交易所网站( http://www.sse.com.cn)刊登的公告为准,敬请广大投资者理性投资,注意风险。
特此公告。
浙江华海药业股份有限公司
董事会
二零二二年三月十八日
《掘金创新药》由联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
根据药渡数据,2022年1月17日至21日,国家药品监督管理局药品审评中心(CDE)共收到10家上市公司提交的17个化学新药、治疗用生物制品新药申请。
一周新药申请
本周上市公司方面,恒瑞医药(600276.SH)提交2个临床申请和1个生产申请;科伦药业(002422.SZ)共申报3个临床申请,信达生物(01801.HK)、博瑞医药(688166.SH)、中国生物制药(01177.HK)旗下正大天晴各申报2个临床申请,浙江医药(600216.SH)、步长制药(603858.SH)、康诺亚-B(02162.HK)、海王生物(000078.SZ)各申报1个临床申请;海思科(002653.SZ)申报1个生产申请。
注:同一公司同一药物不同规格的申报,在上表中不分开列示
一周热评
1、HER2-ADC药物进入密集收获期,ARX788能否助力浙江医药成功转型?
1月21日,CDE官网显示,浙江医药子公司新码生物的注射用重组人源化抗HER2单抗-AS269偶联物(ARX788)临床申请获得受理。
重组人源化抗HER2单抗-AS269偶联注射液是浙江医药于2013年6月14日与美国Ambrx公司签署《合作开发和许可协议》,而后合作研发的新一代单克隆抗体偶联药物,用于治疗HER2阳性晚期乳腺癌和胃癌等。
据浙江医药与Ambrx公司达成的合作协议,浙江医药拥有ARX788在中国的商业开发权利,许可产品在中国上市销售后,Ambrx公司将按净销售额不超过20%的比例提取权益金。
疗效及安全性方面,2020年CSCO大会公布了ARX788治疗HER2阳性乳腺癌患者的Ⅰ期临床数据:1.5mg治疗组患者客观缓解率(ORR)为68.4%,疾病控制率(DCR)达***;既往接受TKI治疗失败患者的ORR为44.7%,安全性良好。
在研发进展方面,2021年5月,ARX788被CDE纳入突破性治疗品种,2021年2月获批开展用于胃癌和胃食管结合部腺癌治疗的Ⅱ/Ⅲ期临床试验。截至发稿前,ARX788的II/III期临床研究据称已进入尾声,预计2022年可递交单药治疗HER2阳性晚期乳腺癌的上市申请。
行业洞察:
由于具备良好的靶向性和抗癌活性,抗体偶联药物(ADC)已成为肿瘤领域药物研发的新热点和重要趋势,正受到越来越多的关注。
根据药渡数据,截至发稿前,国内已有2款HER2-ADC药物获批上市,其中包括*进口药物,即罗氏制药的恩美曲妥珠单抗(Kadcyla,T-DM1);2021年,荣昌生物的HER2-ADC药物——维迪西妥单抗(RC48)获批上市,标志着国产ADC药物的诞生;处于临床三期阶段的有4款,分别为阿斯利康和第一三共的Enhertu、东曜药业的TAA-013、百奥泰的BAT-8001以及浙江医药的ARX-788。此外,还有14款药物处于临床I/II期阶段,其中不乏恒瑞医药、石药集团、科伦药业、三生国健等知名药企。
从上市和申报数据来看,HER2-ADC药物已进入密集收获期。而从靶点趋势来看,国内ADC领域布局最多的就是HER2靶点,其次是Trop-2、cMET、EGFR、CD20等。鉴于国内约三分之一的ADC药物靶向HER2,预计该靶点的ADC药物将面临较为激烈的竞争格局,其在研发进展上的内卷程度比起PD-1/PD-L1亦不遑多让。
公司点评:
安信证券曾在研报中表示,若按照国内新发乳腺癌患者27.89万例、HER2阳性比例25%、病情进展或耐药比例50%、ARX788最终达到30%市占率、药品定价为10万元/年等条件进行估算,ARX788销售峰值有望达10.47亿元。
ARX788的生产及商业化进程也在稳步推进之中,浙江医药于2021年12月30日公告称,拟投资6.2亿元建设年产60万瓶重组人源化抗HER2单抗-AS269偶联制剂产业化项目。据悉,浙江医药计划2022年初启动设计,2022年三季度打桩,预计2024年底建成试生产。试生产完成后将申请GMP认证,预计进展顺利的情况下,2026年初完成GMP认证,认证通过后正式投产。
《掘金创新药》研究员认为,ADC类抗体药物可以随着靶点、抗体技术的提升,在膀胱癌、血液瘤、乳腺癌的基础上不断扩展其他癌种的适应症与其他疾病领域的治疗,未来ADC药物市场的前景巨大。而在公司层面,浙江医药作为我国脂溶性维生素、抗耐药抗生素、喹诺酮类抗生素的主要生产基地,其医药方面业务也正由原料药向创新药、高端制剂产业转型升级,同时子公司新码生物科创板IPO也正在规划中,投资者可持续关注。
2、恒瑞医药阿得贝利单抗申报上市,系国产第五款PD-L1
1月24日,恒瑞医药公告称,子公司上海盛迪医药有限公司收到国家药监局下发的《受理通知书》,公司提交的阿得贝利单抗注射液(SHR-1316)的药品上市许可申请获药监局受理。
阿得贝利单抗是恒瑞医药自主研发的人源化抗PD-L1单克隆抗体,能通过特异性结合PD-L1分子从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活免疫系统的抗肿瘤活性,从而达到治疗肿瘤的目的。截至目前,阿得贝利单抗注射液相关项目累计已投入研发费用约2.74亿元。
行业洞察:
药渡数据显示,截至目前,国内共有12款PD-1/PD-L1上市,其中包括6款国产PD-1、2款国产PD-L1(康宁杰瑞的恩沃利单抗和基石药业的舒格利单抗)、2款进口PD-1和2款进口PD-L1(罗氏的阿替利珠单抗和阿斯利康的度伐利尤单抗)。包括兆科药业的首克注利单抗、科伦药业的泰特利单抗在内,恒瑞医药的阿得贝利单抗为国产第5款申报上市的PD-L1单抗。此外,处于临床一、二、三期的药物分别有60款、44款和17款,且覆盖单抗、双/多抗、小分子等多种分子类型。
公司点评:
《掘金创新药》研究员认为,过去的2021年,恒瑞医药正处于创新药转型关键时期。一方面,在集采常态化、仿制药销售下滑的情况下,公司业绩增速放缓,尤其是在去年三季度,其净利润出现了自上市以来的*负增长,股价也从年初*点一路下挫,几乎腰斩;但另一方面,恒瑞医药目前已手握10款创新药,在研创新药更是多达50多个,并且随着阿得贝利的上市申请获受理,公司仅在过去一个月中上市或申报上市的创新药数量就达到了4款,充分证明恒瑞医药的研发成果输出节奏仍在加速。
据国金证券测算,恒瑞医药的创新药营收占比已由2020年的34%增加到2021年上半年的40%左右。2021年底,恒瑞的8款创新药全部纳入国家医保目录,随着管线中的创新药不断上市以及适应症的不断扩展,预计恒瑞创新药将逐步迎来收获期。
今天的内容先分享到这里了,读完本文《浙海药业》之后,是否是您想找的答案呢?想要了解更多浙海药业、券商指数相关的财经新闻请继续关注本站,是给小编*的鼓励。

在网上平台嬴钱风控部门审核提现失败,网上被黑的情况,可以找...

在平台好的出黑工作室都是有很多办法,不是就是一个办法,解决...
农银理财和农行理财的区别是什么含义不同。农银理财是农业银...
炒股太难?小编带你从零经验变为炒股大神,今天为各位分享《「华利集团公...
本文目录一览:1、20部德国二战电影2、元宇宙概念股有哪些股票...